Dentro del amplio ámbito de la microbiología existen las coloraciones que sirven para poder apreciar y distinguir microorganismos debido a las características que estos poseen. Una de las mas importantes y mas utilizadas es la coloración de Ziehl-Neelsen.
Esta técnica es un tipo de coloración diferencial, lo que implica el uso de
distintos colorantes con la finalidad de crear contraste entre las estructuras
que se desean observar, diferenciar y posteriormente identificar. La tinción de
Ziehl-Neelsen sirve para identificar ciertos tipos de microorganismos.
Algunos de estos microorganismos pueden ser:
1). Micobacterias: Ej: Mycobacterium Tuberculosis,("es la bacteria con mas importancia clínica que se reporta por esta tinción")
2). Parásitos unicelulares: Ej: Nemátodos y Cryptosporidium parvum
3). Nocardias Spp: Nocardia es un género de bacterias Gram-positivas que se encuentran en suelos de todo el mundo ricos en materia orgánica. Son Gram-positivas y con forma de bacilos filamentosos, parecen hilos alargados. Algunas especies son patogénicas que causan nocardiosis.
Como toda coloración en microbiología esta presenta un fundamento el cual será mencionado a continuación:
Fundamento Coloracion de Ziehl-Neelsen
El fundamento de esta técnica de tinción se basa en las
propiedades de la pared celular de estos microorganismos. La pared está formada
por un tipo de ácidos grasos llamados ácidos micólicos; estos se caracterizan
por presentar cadenas muy largas.
Cuando los ácidos grasos presentan estructuras muy largas,
estos pueden retener los colorantes con mayor facilidad. Algunos géneros de
bacterias son muy difíciles de teñir mediante tinción de Gram, debido al alto
contenido de ácidos micólicos de la pared celular.
En la tinción de Ziehl-Neelsen se utiliza el compuesto
fenólico carbol fucsina, un colorante básico. Este tiene la capacidad de
interactuar con los ácidos grasos de la pared celular, la cual es de textura
cerosa a temperatura ambiente.
La tinción con carbol fucsina es mejorada en presencia de
calor, debido a que la cera se derrite y las moléculas de colorante se mueven
con mayor rapidez hacia el interior de la pared celular.
Origen
Roberth Koch anunció su descubrimiento de la tuberculosis el 24 de Marzo de 1882. Logro teñir el bacilo con solución alcohólica concentrada de azul de metileno y decoloración con vesuvina. El bacilo de la tuberculosis y de la lepra tomaban color azul intenso; el tejido y otras bacterias aparecían de color pardo.
Paul Ehrlich, basándose en los hallazgos de Koch, comunicó mes y medio mas tarde su método para teñir el bacilo, que era mas reproducible: introdujo como colorante la solución alcohólica saturada de fucsina, utilizó como mordiente aceite de anilina y continuo decolorando con ácido nítrico.
Franz Ziehl, este cambió el mordiente de Erlich, "aceite de anilina" y lo sustituyo por otra sustancia semejante pero de composición mas precisa. Usó ácido carbolico, con lo cual dio un paso practico tan reproducible que continua usandose hasta nuestros dias con gran eficacia y efectividad.
Friedrich Neelsen comunicó en julio 14 de 1883 que obtenía resultados excelentes con la fucsina en ácido carbólico al 5%, es decir determinó la concentración óptima del mordiente. Asimismo mostró que en sus manos la decoloración con ácido sulfúrico al 25% le daba excelentes resultados.
Existe una profusión enorme de artículos que modifican estos procedimientos básicos. Se varían tiempos, temperatura y decolorantes. La fucsina sigue siendo el colorante básico; el ácido carbólico al 5% es el mordiente ideal y junto con el alcohol absoluto son esenciales para obtener resultados satisfactorios.
La mayoría de las coloraciones iniciales se practicaron en extendidos. En los cortes de tejidos los resultados eran menos reproducibles. Fite revisó los aspectos técnicos generales en 1938, el mismo año en el cual el histotecnólogo brasileño José Faraco publicó sus observaciones, demostrando que el uso de xilol para deparafinar los cortes, impedía la tinción ácido alcohol resistente del bacilo de Hansen y que ésta se conservaba si las preparaciones se trataban con diferentes aceites y grasas tales como aceite Singer para máquinas de coser, aceite de olivas, enjundia de gallina, aceite para motores, aceite de capibara y aceite de hígado de bacalao. Los demás pasos de la técnica seguían las indicaciones clásicas de Ziehl Neelsen. Esta observación esencial constituye la base del método de Fite-Faraco para demostrar el bacilo de Hansen, frecuentemente citado, quizá más como este rotipo que como consulta de las fuentes originales
Controles para la coloración
Cada coloración de Z.N. debe llevar un control adecuado. No es conveniente utilizar un control de bacilos de la tuberculosis ni de infecciones por micobaterias atípicas para los casos de lepra, aunque la situación inversa es posible. Tampoco se deben usar como controles casos de infecciones masivas por micobacterias, con enorme número de bacilos porque allí, a pesar de alguna eventual falla técnica, se pueden teñir algunos microorganismos. El control ideal es aquél que concuerda con el mismo tipo de infección que se pretende demostrar y que tiene una cantidad moderada de bacilos. Durante el proceso de coloración no deben tocarse las láminas entre sí, ni con los controles. Es frecuente que se desprendan bacilos de los casos muy positivos y que flotando en el colorante común a varias láminas, se pasen a áreas de otro lámina, produciendo así una falsa impresión de positividad. Esta es otra razón para utilizar como contraste de fondo la hematoxilina de Harris o el azul de metileno que, al permitir el análisis tisular y citológico, ayudan a deducir por ejemplo que la presencia de bacilos libres entre el colágeno, en las células adiposas, o superpuestos, es un artificio y no una situación tisular real.
Pasos para la realización de una coloración de Ziehl-Neelsen
• Hacer un
extendido en la lámina porta objetos y dejar secar a temperatura ambiente
• Cubra el
extendido con papel filtro y agregue carbolfuscina
• Calentar la lámina pasando la llama de un
mechero por debajo hasta el desprendimiento de vapores. Si el colorante se
empieza a secar, agregue más colorante. Este procedimiento se hace por 5 – 10
minutos.
• Con una pinza descarte el papel y lave la
lámina con agua
• Cubra el extendido con el decolorante Alcohol
ácido por 3 minutos (hasta decolorar) y lave la lámina con agua
• Cubra el extendido con azul de Metileno o
verde de malaquita por 1 minuto
• Lave con agua y
deje secar a temperatura ambiente
• Observe al microscopio con objetivo de
inmersión (100x)
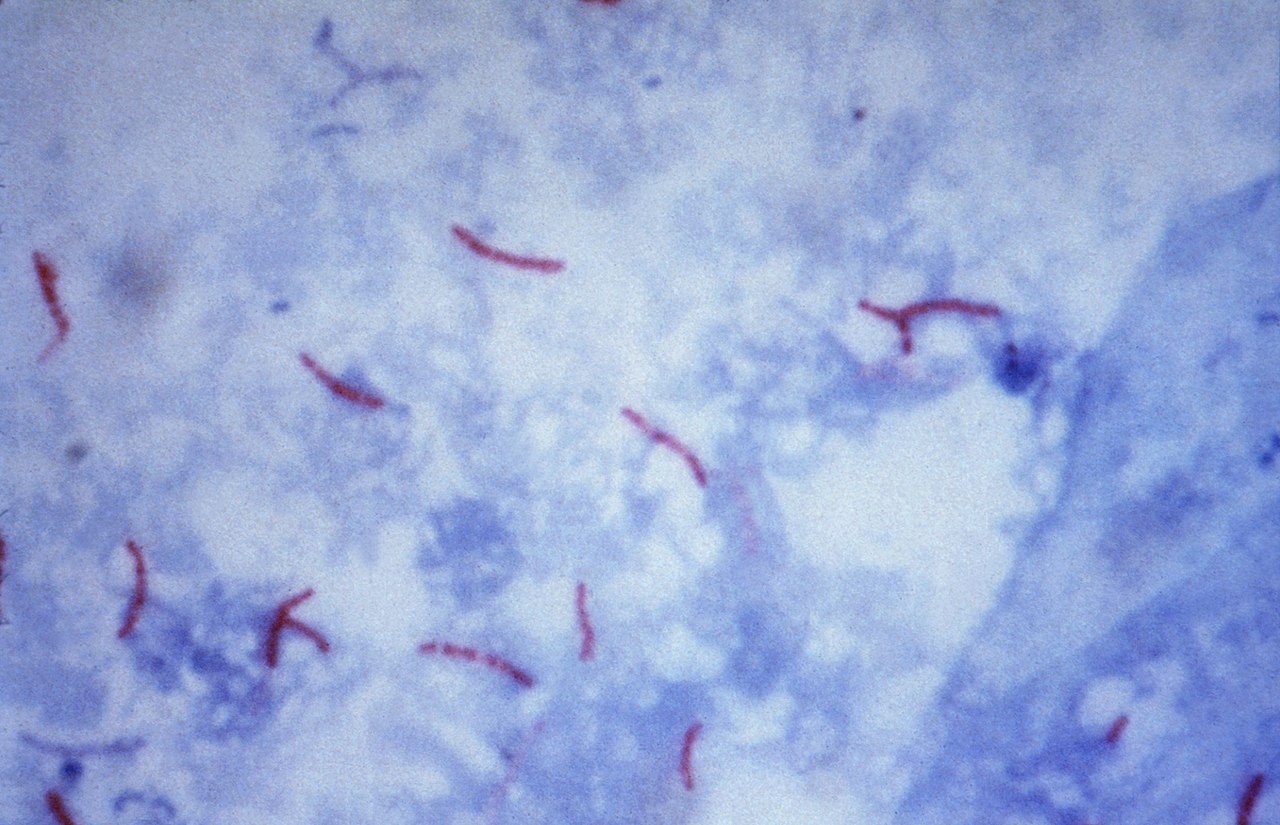
NOTA: Las bacterias ácido alcohol resistente se ven rojas o rosadas y las otras de color azul o verde dependiendo del colorante de contraste utilizado.
Video: https://www.youtube.com/watch?v=ZF154adFuT4
Enfermedad mas frecuente reportada por coloración de Ziehl-Neelsen
(Tuberculosis)
La tuberculosis es una enfermedad infecciosa y
potencialmente seria que afecta principalmente los pulmones. La bacteria que
causa la tuberculosis se contagia de persona a persona a través de pequeñas
gotitas diseminadas en el aire al toser o estornudar.
La tuberculosis también puede afectar otras partes del cuerpo, incluidos los riñones, la columna vertebral o el cerebro. Cuando la tuberculosis se produce fuera de los pulmones, los signos y síntomas varían de acuerdo con los órganos afectados. Por ejemplo, la tuberculosis de la columna vertebral puede provocar dolor en la espalda y la tuberculosis en los riñones puede causar sangre en la orina.
Algunos de los síntomas que provoca son:
• Tos
que dura tres semanas o más
• Tos
con sangre o moco
• Dolor
en el pecho o dolor al respirar o toser
• Pérdida
de peso involuntaria
• Fatiga
• Fiebre
• Sudoraciones
nocturnas
• Escalofríos
• Pérdida
del apetito
"La técnica histológica es un arte y como tal no todos la pueden realizar con igual habilidad. La coloración de Z-N tiene innumerables variables y la mejor es aquella que dé los resultados satisfactorios para cada laboratorio. Estos resultados se deben juzgar con los casos paucibalires y no con las infecciones masivas. Para efectos de la Red Nacional de Laboratorios y para comparar resultados, el uso de una técnica estándar por los laboratorios es una situación ideal y que debe propiciarse".
Bibliografia.
Lifeder (s/f) Tinción
de Ziehl-Neelsen. Lifeder.com. Recuperado el 10 de julio de 2022 en: https://www.lifeder.com/tincion-ziehl-neelsen/
Naranjo, P.
(1998) LA COLORACION DE
ZIEHL-NEELSEN EN HISTOPATOLOGIA. Vol. 8, Nos. 3 y 4. En: file:///D:/Downloads/1964-Texto%20del%20manuscrito%20completo%20(cuadros%20y%20figuras%20insertos)-7352-1-10-20130819.pdf



:quality(85)//cloudfront-us-east-1.images.arcpublishing.com/infobae/7373LRQFBFELTKBYRX3I2MAMNM.jpg)
Comentarios
Publicar un comentario